
Las dos glándulas suprarrenales, con un peso aproximado de 4 g cada una, se hallan en los polos superiores de los riñones. Cada glándula se compone de dos porciones diferentes, la médula suprarrenal y la corteza suprarrenal.
La médula suprarrenal, que ocupa el 20% central de la glándula, se relaciona desde el punto de vista funcional con el sistema nervioso simpático; secreta las hormonas adrenalina y noradrenalina en respuesta a la estimulación simpática.
CORTICOESTEROIDES: MINERALOCORICOIDES, GLUCOCORTICOIDES Y ANDRÓGENOS
La corteza suprarrenal secreta los dos tipos principales de hormonas corticosuprarrenales, losmineralocorticoides y los glucocorticoides. Además de estas hormonas, produce pequeñas cantidades de hormonas sexuales, en particular de andrógenos, que inducen los mismos efectos que la hormona sexual masculina testosterona.
Los mineralocorticoides reciben este nombre porque afectan sobre todo a los electrólitos (los «minerales») del compartimiento extracelular, especialmente al sodio y al potasio. Los glucocorticoides se denominan así porque poseen efectos importantes de aumento de la glucemia.
LA CORTEZA SUPRARRENAL TIENE 3 CAPAS DIFERENTES

En la figura puede verse que la corteza suprarrenal está compuesta por tres capas relativamente diferenciadas:
1. La zona glomerular, una capa delgada de células situada inmediatamente por debajo de la cápsula, contribuye con casi el 15% a la corteza suprarrenal.
2. La zona fascicular, la zona media y más ancha, representa casi el 75% de la corteza suprarrenal y secreta los glucocorticoides cortisol y corticosterona, así como pequeñas cantidades de andrógenos yestrógenos suprarrenales.
3. La zona reticular, la capa más profunda de la corteza, secreta los andrógenos suprarrenalesdeshidroepiandrosterona (DHEA) y androstenodiona, así como pequeñas cantidades de estrógenos y algunos glucocorticoides.
LAS HORMONAS CORTICOSUPRARRENALES SON ESTEROIDES DERIVADOS DEL COLESTEROL
Todas las hormonas esteroideas humanas, incluidas las producidas por la corteza suprarrenal, se sintetizan a partir del colesterol, Si bien las células de la corteza suprarrenal pueden sintetizar de novopequeñas cantidades de colesterol a partir del acetato, casi el 80% del colesterol empleado para la síntesis de esteroides proviene de las lipoproteínas de baja densidad (LDL) del plasma circulante.
Las LDL, que transportan altas concentraciones de colesterol, difunden desde el plasma al líquido intersticial para unirse a receptores específicos localizados en estructuras de la membrana de la célula corticosuprarrenal conocidas como depresiones revestidas.
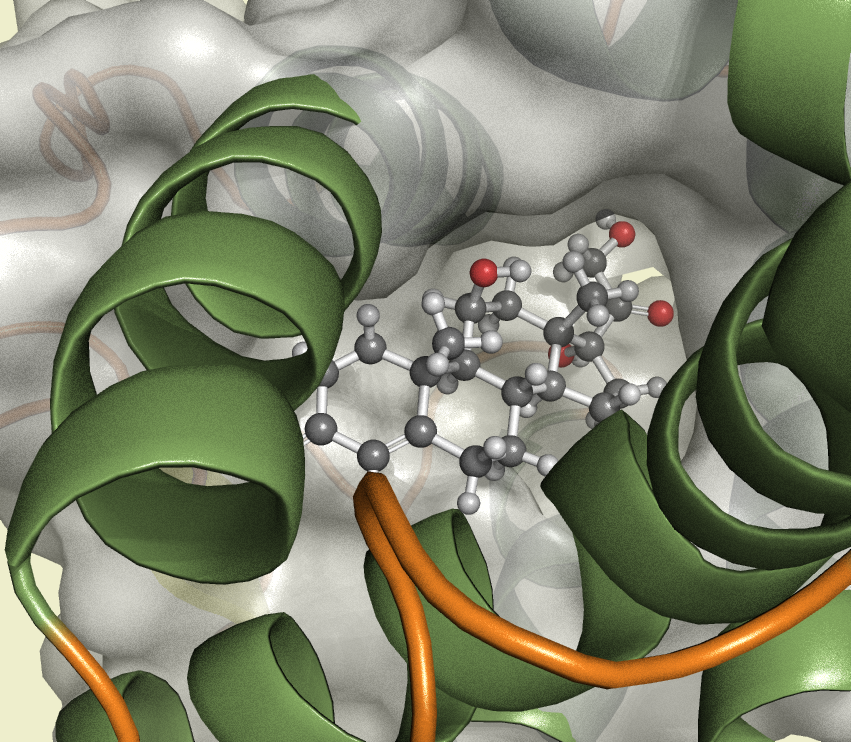
VÍAS DE SÍNTESIS DE LOS ESTEROIDES SUPRARRENALES
La figura indica las etapas principales de la síntesis de los productos esteroideos más importantes de la corteza suprarrenal: aldosterona, cortisol y andrógenos.
Casi todas estas etapas suceden en dos orgánulos celulares, las mitocondrias y el retículo endoplásmico, pero algunas tienen lugar en las primeras y otras en el segundo.
Cada etapa está catalizada por un sistema enzimático específico. Un cambio, incluso de una sola enzima, puede provocar la formación de tipos muy distintos y porcentajes diferentes de hormonas. Por ejemplo, si se altera la actividad de tan solo una enzima de esta vía, se generarán cantidades enormes de hormonas sexuales masculinizantes u otros compuestos esteroideos que normalmente no se encuentran en la sangre.
MINERALOCORTICOIDES
• Aldosterona (muy potente, supone casi el 90% de toda la actividad mineralocorticoide).
• Desoxicorticosterona (1/30 de la potencia de la aldosterona, aunque se secreta en cantidades mínimas).
• Corticosterona (ligera actividad mineralocorticoide).
• 9α-fluorocortisol (sintético, algo más potente que la aldosterona).
• Cortisol (actividad mineralocorticoide mínima, pero se secreta en grandes cantidades).
• Cortisona (actividad mineralocorticoide mínima).
GLUCOCORTICOIDES
• Cortisol (muy potente; es el responsable de casi el 95% de toda la actividad glucocorticoide).
• Corticosterona (proporciona el 4% de la actividad glucocorticoide total, pero es mucho menos potente que el cortisol).
• Cortisona (casi tan potente como el cortisol).
• Prednisona (sintética, cuatro veces más potente que el cortisol).
• Metilprednisolona (sintética, cinco veces más potente que el cortisol).
• Dexametasona (sintética, 30 veces más potente que el cortisol).
LAS HORMONAS CORTICOSUPRARRENALES SE UNEN A LAS PROTEÍNAS DEL PLASMA
Aproximadamente del 90 al 95% del cortisol plasmático se une a las proteínas del plasma, sobre todo a una globulina denominada globulina fijadora del cortisol o transcortina, y en menor grado, a la albúmina. Esta unión tan fuerte a las proteínas del plasma reduce la velocidad de eliminación del cortisol plasmático; por tanto, el cortisol posee una semivida relativamente larga, de 60 a 90 min.
Tan solo el 60% de la aldosterona circulante se une a las proteínas del plasma, de modo que el 40% queda en forma libre; en consecuencia, su semivida es bastante reducida, de unos 20 min.
LAS HORMONAS CORTICOSUPRARRENALES SE METABOLIZAN EN EL HÍGADO

Los esteroides suprarrenales se degradan sobre todo en el hígado, se conjugan, en especial, con el ácido glucurónico y en menor medida forman sulfatos. Estos derivados son sustancias inactivas que carecen de actividad mineralocorticoide y glucocorticoide.
Aproximadamente el 25% de estos conjugados se eliminan por la bilis y luego, por las heces. Los demás conjugados generados en el hígado ingresan en la circulación, pero no se unen a las proteínas plasmáticas, son muy solubles en el plasma y, por esta razón, se filtran con rapidez en los riñones y se excretan con la orina.
LA DEFICIENCIA DE MINERALOCORTICOIDES PROVOCA PÉRDIDAS RENALES INTENSAS DE CLORURO SÓDICO E HIPERPOTASEMIA
La pérdida completa de la secreción corticosuprarrenal puede causar la muerte en un plazo de 3 días a 2 semanas, salvo que la persona reciba un tratamiento salino intensivo o la inyección de mineralocorticoides.
Sin mineralocorticoides, la concentración del ion potasio del líquido extracelular experimenta un gran ascenso, el sodio y el cloruro desaparecen enseguida del organismo y el volumen total del líquido extracelular y el volumen de sangre se reducen mucho.
LA ALDOSTERONA ES EL PRINCIPAL MINERALOCORTICOIDE SECRETADO POR LAS GLÁNDULAS SUPRARRENALES

En el ser humano, la aldosterona es la responsable de casi el 90% de la actividad mineralocorticoide de las secreciones corticosuprarrenales, pero el cortisol, el principal glucocorticoide secretado por la corteza suprarrenal, también aporta una actividad mineralocorticoide importante. La actividad mineralocorticoide de la aldosterona es alrededor de 3.000 veces mayor que la del cortisol, pero la concentración plasmática de este último es casi 2.000 veces superior a la de la aldosterona.
LA ALDOSTERONA AUMENTA LA REABSORCIÓN TUBULAR RENAL DEL SODIO Y LA SECRECIÓN DE POTASIO
Como se recordará del capítulo 28, la aldosterona favorece la reabsorción de sodio y, al mismo tiempo, la secreción de potasio por las células epiteliales de los túbulos renales, sobre todo por las células principales de los túbulos colectores y, en menor medida, en los túbulos distales y los conductos colectores. Por tanto, la aldosterona conserva el sodio en el líquido extracelular y aumenta la eliminación urinaria de potasio.
El incremento de la concentración de aldosterona del plasma puede reducir de forma pasajera la pérdida urinaria de sodio y dejarla en unos pocos miliequivalentes al día.
EL EXCESO DE ALDOSTERONA AUMENTA EL VOLUMEN DEL LÍQUIDO EXTRACELULAR Y LA PRESIÓN ARTERIAL, PERO EJERCE MUY POCO EFECTO SOBRE LA CONCENTRACIÓN DE SODIO PLÁSMATICO
Si bien la aldosterona ejerce un potente efecto reductor de la excreción renal de los iones sodio, la concentración de estos en el líquido extracelular asciende, por lo general, solo unos pocos miliequivalentes.
El motivo es que, cuando se reabsorbe el sodio en el líquido por los túbulos, se produce al mismo tiempo una absorción osmótica de cantidades casi equivalentes de agua. De igual modo, los pequeños incrementos del sodio en el líquido extracelular estimulan la sed e incitan al consumo de agua, si se dispone de ella, además de favorecer la secreción de la hormona antidiurética, que promueve la reabsorción de agua por los túbulos distales y colectores de los riñones.
EL EXCESO DE ALDOSTERONA PRODUCE HIPOPOTASEMIA Y DEBILIDAD MUSCULAR; EL DÉFICIT DE ALDOSTERONA INDUCE HIPERPOTASEMIA Y TOXICIDAD CARDÍACA
El exceso de aldosterona no solo provoca la de iones potasio desde el líquido extracelular hacia la orina, sino que también estimula el transporte de potasio desde el líquido extracelular hacia la mayoría de las células del organismo. Por consiguiente, la secreción excesiva de aldosterona, como ocurre con algunos tipos de tumores suprarrenales, induce un descenso importante de la concentración plasmática de potasio, a veces desde valores normales de 4,5 mEq/l hasta cifras tan bajas como 2 mEq/l. Esta situación se denomina hipopotasemia.
EL EXCESO DE ALDOSTERONA AUMENTA LA SECRECIÓN TUBULAR DE IONES HIDRÓGENO, CON LA SIGUIENTE ALCALOSIS LEVE
La aldosterona no solo induce la secreción tubular de potasio, que se intercambia por el sodio reabsorbido en las células principales de los tubos colectores renales, sino que también provoca una secreción de iones hidrógeno, intercambiados por potasio, por parte de las células intercaladas de los tubos colectores corticales, como se expone en los capítulos 28 y 31.
LA ALDOSTERONA ESTIMULA EL TRANSPORTE DE SODIO Y POTASIO EN LAS GLÁNDULAS SUDORÍPARAS, LAS GLÁNDULAS SALIVALES Y LAS CÉLULAS EPITELIALES INTESTINALES
La aldosterona ejerce casi los mismos efectos sobre las glándulas sudoríparas y salivales que sobre los túbulos renales. Estos dos tipos de glándulas producen una secreción primaria que contiene grandes cantidades de cloruro sódico, aunque gran parte del cloruro sódico se reabsorbe al atravesar los conductos excretores, mientras que los iones potasio y bicarbonato se excretan. La aldosterona aumenta de manera considerable la reabsorción de cloruro sódico y la secreción de potasio por los conductos.

MECANISMO CELULAR DE LA ACCIÓN DE LA ALDOSTERONA
Desde hace muchos años se conocen los efectos generales de los mineralocorticoides sobre el organismo, pero se ignora el mecanismo molecular de la acción de la aldosterona incrementa el transporte de sodio en las células tubulares. No obstante, la secuencia celular de acontecimientos que culmina con el aumento de la reabsorción de sodio parece ser la siguiente.
En primer lugar, la aldosterona difunde de inmediato al interior de las células del epitelio tubular, debido a su liposolubilidad en las membranas celulares.
En segundo lugar, la aldosterona se une a la proteína receptor mineralocorticoide (MR) una proteína que dispone de una configuración estereomolecular por la que solo la aldosterona o compuestos muy parecidos se unen a ella.
POSIBLES ACCIONES NO GENÓMICAS DE LA ALDOSTERONA Y OTRAS HORMONAS ESTEROIDEAS
Algunos estudios indican que muchos esteroides, entre ellos la aldosterona, no solo producen efectosgenómicos de desarrollo lento, con una latencia de 45 a 60 min y que dependen de la transcripción del gen y de la síntesis de nuevas proteínas, sino que también tienen efectos más rápidos no genómicos, que aparecen luego de tan solo pocos segundos a algunos minutos.
Parece que estas acciones no genómicas dependen de la unión de los esteroides a receptores de la membrana celular que se acoplan a sistemas de segundos mensajeros, similares a los utilizados por las hormonas peptídicas para la transmisión de señales.
REGULACIÓN DE LA SECRECIÓN DE ALDOSTERONA
La regulación de la secreción de aldosterona por las células de la zona glomerular no depende apenas de la regulación del cortisol o de los andrógenos por las zonas fascicular y reticular.
Se conocen los siguientes cuatro factores que desempeñan una función esencial para la regulación de la aldosterona:
1. El incremento de la concentración de iones potasio en el líquido extracelular aumenta mucho la secreción de aldosterona.
2. El aumento de la concentración de angiotensina II en el líquido extracelular también incrementa mucho la secreción de aldosterona.
3. El incremento de la concentración de iones sodio en el líquido extracelular apenas reduce la secreción de aldosterona.
4. Se necesita ACTH de la adenohipófisis para que haya secreción de aldosterona, aunque su efecto regulador sobre la velocidad de secreción es mínimo en la mayoría de los trastornos fisiológicos.
FUNCIONES DE LOS GLUCOCORTICOIDES
Los mineralocorticoides pueden salvar la vida de los animales sometidos a suprarrenalectomía aguda, pero estos animales no se encuentran ni mucho menos bien. En realidad, los sistemas metabólicos animales de utilización de las proteínas, hidratos de carbono y lípidos están muy alterados. Además, el animal no resiste ningún tipo de estrés físico o mental y cualquier enfermedad leve, como una infección respiratoria, puede causar su muerte.
Por tanto, los glucocorticoides ejercen funciones tan esenciales para prolongar la vida de los animales como las de los mineralocorticoides. Estas funciones se expondrán en los siguientes apartados.
ESTIMULACIÓN DE LA GLUCONEOGENIA
El efecto metabólico más conocido del cortisol y de otros glucocorticoides consiste en estimular la gluconeogenia (es decir, la formación de hidratos de carbono a partir de las proteínas y de otras sustancias) en el hígado; el ritmo de gluconeogenia se eleva, a menudo, entre 6 y 10 veces. Este aumento del ritmo de la gluconeogenia se debe, sobre todo, a los efectos directos del cortisol en el hígado, así como a la antagonización de los efectos de la insulina.
1. El cortisol aumenta las enzimas que convierten los aminoácidos en glucosa dentro de los hepatocitos.
2. El cortisol moviliza los aminoácidos de los tejidos extrahepáticos, sobre todo del músculo. Por ello, llegan más aminoácidos al plasma, para incorporarse a la gluconeogenia hepática y facilitar la formación de glucosa.
3. El cortisol antagoniza los efectos de la insulina para inhibir la gluconeogenia en el hígado. Tal como se expone en el capítulo 79, la insulina estimula la síntesis de glucógeno en el hígado e inhibe las enzimas que intervienen en la generación de glucosa por parte del hígado.
DISMINUCIÓN DE LA UTILIZACIÓN CELULAR DE LA GLUCOSA
El cortisol también reduce, aunque en grado moderado, la utilización de glucosa por la mayoría de las células del cuerpo. Aunque se desconoce la causa exacta de este descenso, un efecto importante del cortisol es la reducción de la translocación de los transportadores de glucosa GLUT-4 en la membrana celular, en especial en las células del músculo esquelético, lo que conduce a resistencia a la insulina.
INCREMENTO DE LA GLUCEMIA Y DIABETES SUPRARRENAL
El incremento de la glucemia se debe tanto al incremento de la gluconeogenia como a la reducción moderada de la utilización celular de la glucosa. A su vez, el aumento de la concentración de glucosa estimula la secreción de insulina. Sin embargo, la elevación de los valores plasmáticos de insulina no resulta tan eficaz para mantener la glucosa plasmática como en condiciones normales.
Por las razones que se expusieron anteriormente, los valores elevados de glucocorticoides reducen la sensibilidad de muchos tejidos, en particular del músculo esquelético y del tejido adiposo, a los efectos favorecedores de la captación y utilización de glucosa característicos de la insulina.

REDUCCIÓN DE LAS PROTEÍNAS CELULARES
Uno de los principales efectos del cortisol sobre los sistemas metabólicos del organismo consiste en el descenso de los depósitos de proteínas de la práctica totalidad de las células del organismo, con excepción de las del hígado. Esta reducción se debe tanto al descenso de la síntesis como a un mayor catabolismo de las proteínas ya existentes dentro de las células.
EL CORTISOL AUMENTA LAS PROTEÍNAS DEL HÍGADO Y EL PLASMA
Al mismo tiempo que el efecto de los glucocorticoides reduce las proteínas de otros lugares del organismo, el cortisol estimula la producción de proteínas en el hígado. Además, las proteínas del plasma (formadas por el hígado y liberadas a la sangre) también aumentan. Estos incrementos suponen una excepción al descenso de las proteínas que tiene lugar en otras partes del cuerpo.
AUMENTO DE LOS AMINOÁCIDOS SANGUÍNEOS, DISMINUCIÓN DEL TRANSPORTE DE LOS AMINOÁCIDOS A LAS CÉLULAS EXTRAHEPÁTICAS Y ESTIMULACIÓN DEL TRANSPORTE A LOS HEPATOCITOS
Los estudios con tejidos aislados han revelado que el cortisol reduce el transporte de aminoácidos a las células musculares y quizás a otras células extrahepáticas.
Este menor transporte de aminoácidos a las células extrahepáticas disminuye la concentración intracelular de estas sustancias y, por tanto, la síntesis de proteínas. Sin embargo, el catabolismo de las proteínas en las células continúa liberando aminoácidos que difunden al exterior de la célula, con ascenso de sus concentraciones plasmáticas.
MOVILIZACIÓN DE LOS ÁCIDOS GRASOS
De forma muy similar a la movilización de aminoácidos del músculo, el cortisol moviliza a los ácidos grasos del tejido adiposo. Esta movilización aumenta la concentración de ácidos grasos libres en el plasma, lo que aumenta también la utilización de los ácidos grasos con fines energéticos. Al parecer, el cortisol ejerce asimismo un efecto directo que potencia la oxidación de los ácidos grasos en el interior de la célula.
EL EXCESO DE CORTISOL INDUCE A LA OBESIDAD
Si bien el cortisol puede provocar una movilización moderada de los ácidos grasos en el tejido adiposo, en muchas personas que presentan una secreción excesiva de cortisol se desarrolla un tipo de obesidad peculiar: la grasa sobrante se deposita en el tórax y en la cabeza, y produce el «cuello de búfalo» y la cara redonda «de luna llena».
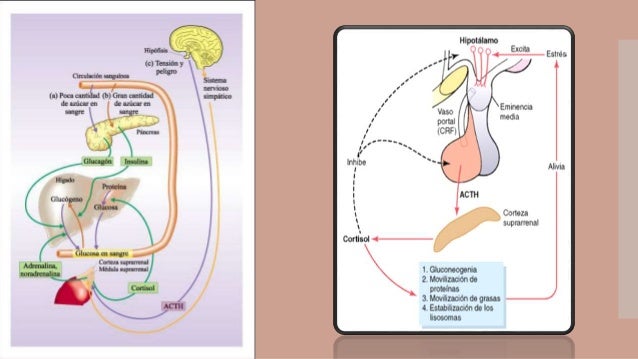
EL CORTISOL ES IMPORTANTE PARA RESISTIR EL ESTRÉS Y LA INFLAMACIÓN
Prácticamente cualquier tipo de estrés, ya sea físico o neurógeno, provoca un aumento inmediato y notable de la secreción de ACTH por la adenohipófisis, seguido unos minutos después de una secreción considerable de cortisol por la corteza suprarrenal.
En la siguiente lista se detallan algunos tipos de estrés que aumentan la liberación de cortisol:
- Traumatismo.
- Infección.
- Calor o frío intensos.
- Inyección de noradrenalina y otros simpaticomiméticos.
- Cirugía.
- Inyección de sustancias necrosantes bajo la piel.
- Inmovilización del animal.
- Enfermedades debilitantes
EFECTOS ANTIINFLAMATORIOS DE LAS CONCENTRACIONES ALTAS DE CORTISOL
Cuando un tejido sufre daños a causa de un traumatismo, una infección bacteriana o cualquier otra causa, suele «inflamarse». A veces, como ocurre en la artritis reumatoide, la inflamación resulta más nociva que el traumatismo o la enfermedad. La administración de grandes cantidades de cortisol permite, de ordinario, bloquear esta inflamación o incluso revertir muchos de sus efectos, una vez iniciada. Antes de explicar los mecanismos por los que el cortisol bloquea la inflamación, se revisará la secuencia básica de esta, que se trata con mayor detalle en el capítulo 34.
EL CORTISOL IMPIDE LA INFLAMACIÓN TANTO POR ESTABILIZACIÓN DE LOS LISOSOMAS COMO A TRAVÉS DE OTROS EFECTOS

El cortisol ejerce los siguientes efectos preventivos de la inflamación:
1. El cortisol estabiliza las membranas lisosómicas. Esta estabilización es uno de los efectos antiinflamatorios de mayor interés, porque aumenta la resistencia a la rotura de las membranas de los lisosomas intracelulares.
2. El cortisol reduce la permeabilidad de los capilares, quizá como un efecto secundario a la menor liberación de las enzimas proteolíticas.
3. El cortisol disminuye la migración de los leucocitos a la zona inflamada y la fagocitosis de las células dañadas.
4. El cortisol inhibe al sistema inmunitario y reduce mucho la multiplicación de los linfocitos, sobre todo de los linfocitos T.
5. El cortisol disminuye la fiebre, sobre todo porque reduce la liberación de interleucina 1 por los leucocitos, uno de los principales estimuladores del sistema termorregulador hipotalámico.
EL CORTISOL RESUELVE LA INFLAMACIÓN

Incluso después de establecida la inflamación, la administración de cortisol puede reducirla en un plazo de horas a días. Bloquea casi todos los factores que fomentan el proceso y, además, acelera la cicatrización. Sin embargo, es muy probable que la explicación resida en los mismos factores, en su mayoría desconocidos, que permiten al organismo resistir muchos otros tipos de estrés físico cuando se secretan grandes cantidades de cortisol.
EL CORTISOL BLOQUEA LA RESPUESTA INFLAMATORIA A LAS REACCIONES ALÉRGICAS
El cortisol no influye en la reacción alérgica básica entre el antígeno y el anticuerpo, por lo que pueden incluso observarse algunos efectos secundarios de la reacción alérgica. Sin embargo, como la respuesta inflamatoria causa muchos de los efectos graves y a veces mortales de las reacciones alérgicas, la administración de cortisol, seguida de su efecto antiinflamatorio y de la menor liberación de productos inflamatorios, puede salvar la vida del paciente.